هل تساءلت يومًا عن سبب ترتيب العناصر الكيميائية في صفوف وأعمدة في الجدول الدوري؟ يكمن السر في الدورة والمجموعة، وهما مفهومان مهمان يساعداننا على فهم خصائص وتغيرات “لبنات البناء” التي تشكل هذا الكون. إذا كنت تبحث عن طريقة الدراسة الصحيحة لمختلف المراحل التعليمية، وخاصة في مادة الكيمياء، فدع “هيا نتعلم” يكشف لك كيفية التعرف على الدورات والمجموعات في الكيمياء، وتحويل المعرفة التي تبدو جافة إلى لغز منطقي ممتع.
الدورة: رحلة استكشاف أغلفة الإلكترون
تخيل أنك في رحلة حول أغلفة الإلكترون للذرة. كل دورة تمر بها هي دورة في الجدول الدوري. يتطابق رقم الدورة مع عدد أغلفة الإلكترون للذرة، وكذلك عدد الإلكترونات في الغلاف الخارجي للعنصر في حالته الأساسية. على سبيل المثال، يقع عنصر الصوديوم (Na) في الدورة 3، مما يعني أن ذرة الصوديوم لديها 3 أغلفة إلكترونية، والغلاف الخارجي يحتوي على إلكترون واحد.
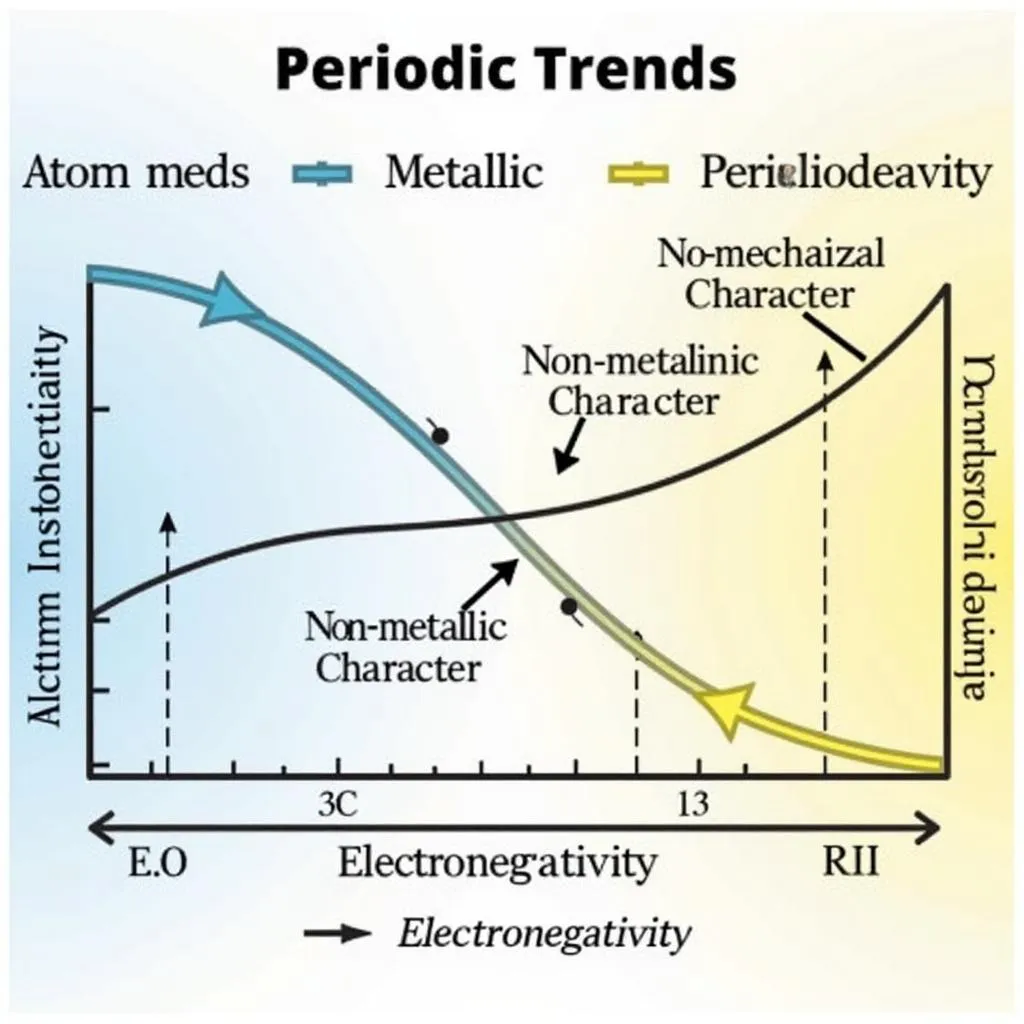
ولكن ما هو أكثر إثارة من استكشاف التحول السحري للعناصر في كل دورة؟ عند الانتقال من اليسار إلى اليمين في نفس الدورة، سترى:
- نصف قطر الذرة: يتناقص تدريجياً.
- الخاصية الفلزية: تتناقص تدريجياً، بينما الخاصية اللافلزية: تزداد تدريجياً.
- الكهروسلبية: تزداد تدريجياً.
المجموعة: ملتقى العناصر المتشابهة
بعد ترك رحلة استكشاف أغلفة الإلكترون، ننتقل إلى مجموعات العناصر – ملتقى الذرات ذات التوجهات المشتركة، والتي لها نفس عدد الإلكترونات في الغلاف الخارجي. يشير الرقم التسلسلي للمجموعة A (من IA إلى VIIIA) إلى عدد الإلكترونات في الغلاف الخارجي للذرة. على سبيل المثال، ينتمي عنصر الأكسجين (O) إلى المجموعة VIA، مما يعني أن ذرة الأكسجين لديها 6 إلكترونات في الغلاف الخارجي.
وهل تعلم أن عدد الإلكترونات في الغلاف الخارجي هو الذي يحدد الخواص الكيميائية للعنصر. العناصر الموجودة في نفس المجموعة لها خواص كيميائية متشابهة. على سبيل المثال، المجموعة IA (الفلزات القلوية) كلها “شباب” نشطون، يسهل عليهم التخلي عن إلكترون واحد في الغلاف الخارجي لتكوين أيونات موجبة.
التمييز بين المجموعة A والمجموعة B
بالإضافة إلى المجموعة A، يحتوي الجدول الدوري أيضًا على المجموعة B، وهي تجمع للعناصر الانتقالية. يكمن الاختلاف الأساسي بين هاتين المجموعتين في الإلكترون الأخير الذي يتم ملؤه:
- المجموعة A: يتم ملء الإلكترون الأخير في المستوى الفرعي s أو p.
- المجموعة B: يتم ملء الإلكترون الأخير في المستوى الفرعي d أو f.
أسرار تذكر الدورات والمجموعات
شارك المعلم نجوين فان أ، وهو معلم كيمياء ذو خبرة في مدرسة هانوي-أمستردام الثانوية المتخصصة، سر “التعرف بمجرد النظر” على دورة ومجموعة عنصر ما: “احفظ التوزيع الإلكتروني للذرة عن ظهر قلب. من التوزيع الإلكتروني، يمكننا بسهولة تحديد عدد أغلفة الإلكترون (الدورة) وعدد الإلكترونات في الغلاف الخارجي (المجموعة A) لهذا العنصر.”
الخلاصة: رحلة غزو الجدول الدوري
إن التعرف على الدورات والمجموعات لا يساعدك فقط على “النجاة” من اختبارات الكيمياء، بل يفتح أيضًا الباب للدخول إلى العالم الغامض للعناصر. نأمل أن يكون هذا المقال قد قدم لك معرفة مفيدة ومثيرة للاهتمام حول كيفية التعرف على الدورات والمجموعات في الكيمياء. تابع “هيا نتعلم” لاكتشاف المزيد من الأشياء الممتعة حول عالم العلوم! إذا كنت ترغب في معرفة المزيد عن كيفية كتابة الصيغ الكيميائية، فتفضل بزيارة المقال المفصل على موقعنا.
ولا تنسَ، إذا كان لديك أي أسئلة أو كنت بحاجة إلى مساعدة، فيرجى الاتصال بنا عبر الهاتف: 0372888889، أو زيارة العنوان: 335 Nguyen Trai، Thanh Xuan، Hanoi. لدينا فريق خدمة عملاء على مدار الساعة طوال أيام الأسبوع.