Bạn có bao giờ tự hỏi tại sao các nguyên tố hóa học lại được sắp xếp theo hàng ngang, cột dọc trong bảng tuần hoàn? Bí mật nằm ở chu kỳ và nhóm, hai khái niệm quan trọng giúp chúng ta hiểu rõ hơn về tính chất và sự biến đổi của các “viên gạch” tạo nên vũ trụ này. Nếu bạn đang loay hoay tìm cách học đúng đắn đối với các cấp học, đặc biệt là với môn Hóa học, thì hãy cùng “HỌC LÀM” giải mã cách nhận biết chu kỳ nhóm trong hóa học, biến những kiến thức tưởng chừng khô khan thành bài toán logic đầy thú vị.
Chu kỳ: Hành Trình Khám Phá Lớp Vỏ Electron
Tưởng tượng bạn đang tham gia một chuyến du lịch vòng quanh các lớp vỏ electron của nguyên tử. Mỗi vòng bạn đi qua chính là một chu kỳ trên bảng tuần hoàn. Số thứ tự chu kỳ trùng với số lớp electron của nguyên tử, cũng như số electron lớp ngoài cùng của nguyên tố khi ở trạng thái cơ bản. Ví dụ, nguyên tố Natri (Na) nằm ở chu kỳ 3, có nghĩa là nguyên tử Natri có 3 lớp electron và lớp ngoài cùng có 1 electron.
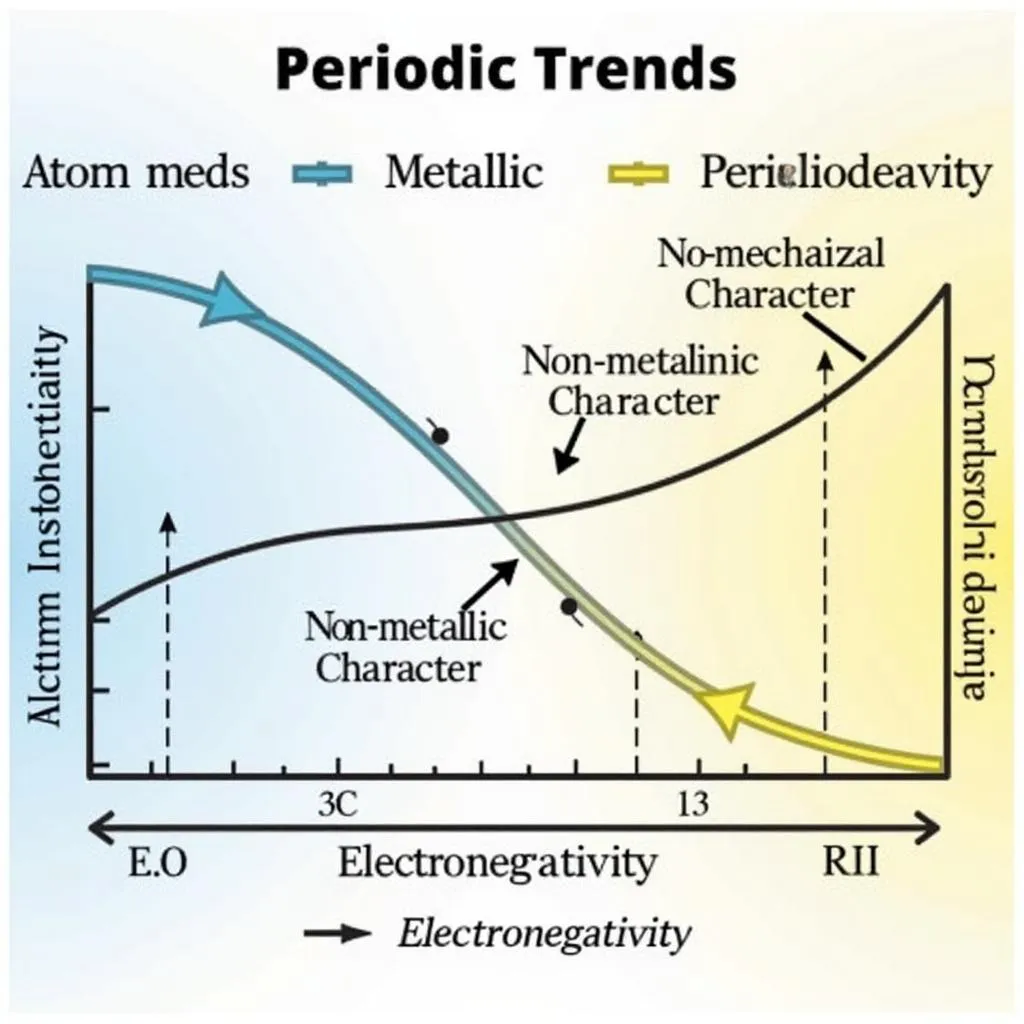
Nhưng còn gì thú vị hơn việc khám phá sự biến đổi kỳ diệu của các nguyên tố trong mỗi chu kỳ? Khi di chuyển từ trái sang phải trong cùng một chu kỳ, bạn sẽ thấy:
- Bán kính nguyên tử: Giảm dần.
- Tính kim loại: Giảm dần, trong khi tính phi kim: Tăng dần.
- Độ âm điện: Tăng dần.
Nhóm: Nơi Hội Tụ Của Những Nguyên Tố Đồng Cảm
Rời khỏi chuyến du lịch vòng quanh lớp vỏ electron, chúng ta cùng đến với những nhóm nguyên tố – nơi hội tụ của những nguyên tử có chung chí hướng, có cùng số electron lớp ngoài cùng. Số thứ tự của nhóm A (từ IA đến VIIIA) cho biết số electron lớp ngoài cùng của nguyên tử. Ví dụ, nguyên tố Oxi (O) thuộc nhóm VIA, có nghĩa là nguyên tử Oxi có 6 electron lớp ngoài cùng.
Và bạn biết không, chính số electron lớp ngoài cùng này quyết định đến tính chất hóa học của nguyên tố. Các nguyên tố cùng nhóm sẽ có tính chất hóa học tương tự nhau. Ví dụ, nhóm IA (kim loại kiềm) đều là những “chàng trai” năng động, dễ dàng cho đi 1 electron lớp ngoài cùng để tạo thành ion dương.
Phân biệt nhóm A và nhóm B
Ngoài nhóm A, bảng tuần hoàn còn có nhóm B, nơi quy tụ các nguyên tố chuyển tiếp. Điểm khác biệt cơ bản giữa hai nhóm này nằm ở electron cuối cùng được điền vào:
- Nhóm A: Electron cuối cùng được điền vào phân lớp s hoặc p.
- Nhóm B: Electron cuối cùng được điền vào phân lớp d hoặc f.
Bí Quyết Ghi Nhớ Chu Kỳ Nhóm
Thầy Nguyễn Văn A, một giáo viên Hóa học giàu kinh nghiệm tại trường THPT chuyên Hà Nội – Amsterdam, đã chia sẻ bí quyết “nhìn là biết” chu kỳ nhóm của một nguyên tố: “Hãy thuộc lòng cấu hình electron nguyên tử. Từ cấu hình electron, ta dễ dàng xác định được số lớp electron (chu kỳ) và số electron lớp ngoài cùng (nhóm A) của nguyên tố đó.”
Kết Luận: Hành Trình Chinh Phục Bảng Tuần Hoàn
Việc nhận biết chu kỳ nhóm không chỉ giúp bạn “sống sót” qua những bài kiểm tra Hóa học mà còn mở ra cánh cửa bước vào thế giới đầy bí ẩn của các nguyên tố. Hy vọng bài viết này đã cung cấp cho bạn những kiến thức bổ ích và lý thú về cách nhận biết chu kỳ nhóm trong hóa học. Hãy tiếp tục theo dõi “HỌC LÀM” để khám phá thêm nhiều điều thú vị về thế giới khoa học bạn nhé! Nếu bạn muốn tìm hiểu thêm về cách ghi công thức hóa học, hãy ghé thăm bài viết chi tiết trên website của chúng tôi.
Và đừng quên, nếu bạn có bất kỳ câu hỏi nào hoặc cần hỗ trợ, hãy liên hệ với chúng tôi qua số điện thoại: 0372888889, hoặc đến địa chỉ: 335 Nguyễn Trãi, Thanh Xuân, Hà Nội. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.