Você já se perguntou por que os elementos químicos são organizados em linhas horizontais e verticais na tabela periódica? O segredo está nos períodos e grupos, dois conceitos essenciais que nos ajudam a entender as propriedades e variações dos “blocos de construção” deste universo. Se você está se sentindo perdido e buscando maneiras eficazes de estudar em todos os níveis de ensino, especialmente em Química, junte-se ao “HỌC LÀM” para decifrar como identificar períodos e grupos em química, transformando o conhecimento aparentemente árido em um quebra-cabeça lógico e fascinante.
Períodos: Uma Jornada Pela Camada Eletrônica
Imagine que você está em uma viagem ao redor das camadas eletrônicas de um átomo. Cada volta que você completa é um período na tabela periódica. O número do período corresponde ao número de camadas eletrônicas do átomo, bem como ao número de elétrons na camada mais externa do elemento em seu estado fundamental. Por exemplo, o elemento Sódio (Na) está no período 3, o que significa que um átomo de Sódio possui 3 camadas eletrônicas e 1 elétron na camada mais externa.
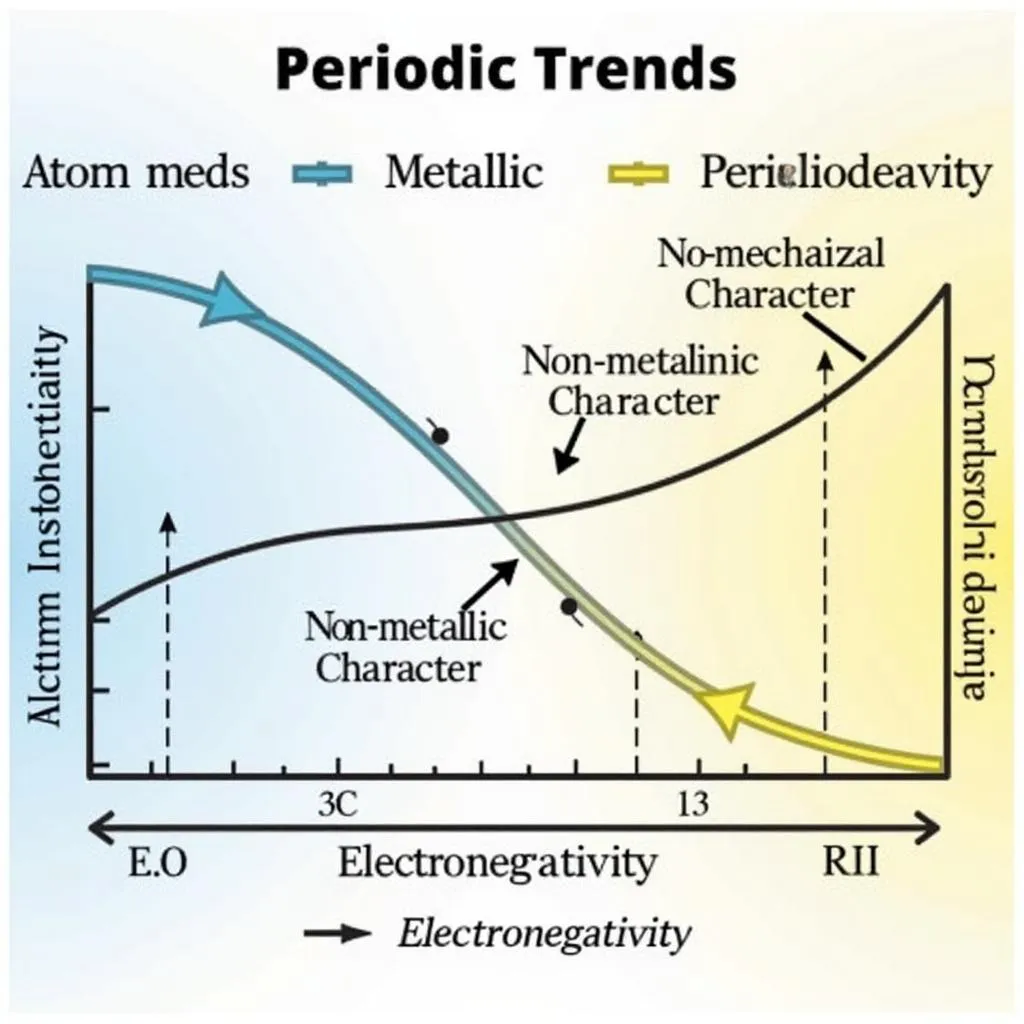
Mas o que é ainda mais interessante é descobrir a variação mágica das propriedades dos elementos em cada período! Ao se mover da esquerda para a direita no mesmo período, você notará:
- Raio atômico: Diminui gradualmente.
- Caráter metálico: Diminui gradualmente, enquanto o caráter não metálico: Aumenta gradualmente.
- Eletronegatividade: Aumenta gradualmente.
 Variação das propriedades dos elementos em um período
Variação das propriedades dos elementos em um período
Grupos: O Ponto de Encontro de Elementos Semelhantes
Deixando para trás a jornada ao redor das camadas eletrônicas, vamos agora aos grupos de elementos – o ponto de encontro de átomos com propósitos semelhantes, que compartilham o mesmo número de elétrons na camada mais externa. O número do grupo A (do IA ao VIIIA) indica o número de elétrons na camada mais externa do átomo. Por exemplo, o elemento Oxigênio (O) pertence ao grupo VIA, o que significa que um átomo de Oxigênio possui 6 elétrons na camada mais externa.
E você sabia que é esse número de elétrons na camada mais externa que determina as propriedades químicas de um elemento? Elementos do mesmo grupo terão propriedades químicas semelhantes. Por exemplo, o grupo IA (metais alcalinos) são todos “garotos” enérgicos, facilmente doando 1 elétron da camada mais externa para formar íons positivos.
Diferenciando Grupos A e Grupos B
Além dos grupos A, a tabela periódica também possui grupos B, onde se reúnem os elementos de transição. A principal diferença entre esses dois grupos reside no último elétron a ser preenchido:
- Grupos A: O último elétron é adicionado ao subnível s ou p.
- Grupos B: O último elétron é adicionado ao subnível d ou f.
 Diagrama de classificação dos grupos de elementos A e B
Diagrama de classificação dos grupos de elementos A e B
Segredo para Memorizar Períodos e Grupos
O professor Nguyễn Văn A, um experiente professor de Química da escola de ensino médio especializada Hanoi – Amsterdam, compartilhou um segredo para “identificar instantaneamente” o período e o grupo de um elemento: “Memorize a configuração eletrônica do átomo. A partir da configuração eletrônica, podemos facilmente determinar o número de camadas eletrônicas (período) e o número de elétrons na camada mais externa (grupo A) desse elemento.”
Conclusão: Uma Jornada para Conquistar a Tabela Periódica
Reconhecer períodos e grupos não apenas ajuda você a “sobreviver” aos testes de Química, mas também abre as portas para o mundo misterioso dos elementos. Esperamos que este artigo tenha fornecido a você conhecimentos úteis e interessantes sobre como identificar períodos e grupos em química. Continue acompanhando “HỌC LÀM” para descobrir mais coisas interessantes sobre o mundo da ciência, ok? Se você quiser saber mais sobre como escrever fórmulas químicas, visite o artigo detalhado em nosso site.
E não se esqueça, se você tiver alguma dúvida ou precisar de suporte, entre em contato conosco pelo telefone: 0372888889 ou visite-nos no endereço: 335 Nguyễn Trãi, Thanh Xuân, Hanói. Temos uma equipe de atendimento ao cliente 24 horas por dia, 7 dias por semana.